0 引 言
全球变暖是世界各国共同关注的热点问题,温室气体的大量排放是导致这一现象的主要原因之一。而对于温室气体主要成分之一的CO2,控制其排放至关重要[1]。CO2的捕集、利用与存储(CCUS)是减少碳排放的有效技术之一,得到了越来越多的关注[2-3]。此技术可将工业过程如水泥工业、钢铁工业、燃煤电厂、化工企业等排放的CO2进行分离脱除。一方面CO2捕集后可将其投入到其他生产过程;另一方面可将捕集的CO2输送到油田、海洋等地点进行封存,以待循环再利用。该技术有利于降低CO2大规模排放,被认为是缓解气候变化所致环境问题的比较经济可行的办法。
目前全球共有51个大型一体化CCUS项目,其中18个商运阶段的项目可实现4 500万t CO2捕集规模,在建的5个项目预计具有1 030万~1 140万t的CO2捕集潜力。加拿大边界大坝(Boundary Dam)项目是全球首个燃煤电厂百万吨级燃烧后CO2捕集与封存项目,2014年10月建成,自运行以来已累计捕集CO2达415万t,CO2纯度可达99%。美国佩特拉诺瓦(Petra Nova)项目属全球最大的燃煤电厂烟气CO2捕集与封存商业项目,总体投资约10.4亿美元,2017年10月启动,在运行10个月后累计捕集100万t CO2,单位捕集能耗约2.4 GJ/t(以CO2计,下同),捕集成本为55~60美元/t。挪威富腾垃圾发电厂项目是全球首个垃圾发电CO2捕集与封存商业项目,设计年捕集40万t CO2,捕集率95%,2020年5月完成前端工程设计。我国已建成35个CCUS示范项目,捕集能力超过300万t/a,2017—2019年累计CO2封存量约为200万t。2008年7月,中国首个CO2捕集装置(3 000 t/a)在华能北京热电厂投入运行,该装置由华能独立设计和建造,捕集的CO2实现了资源化利用。2020年,华能研制出我国首台1 000 t/a“相变”碳捕集工业装置,在华能长春热电厂实现连续稳定运行。两相碳捕获技术属于新一代的碳捕集技术,有效解决传统方法中加热所有CO2吸收液引起的高能耗问题,可以大大减少CO2捕集成本,能耗≤2.3 GJ/t。
CCUS技术中,对于CO2的分离脱除措施一般可分为燃烧前捕集、燃烧后捕集以及富氧燃烧捕集[4]。我国自2010年以来,每年约70%的电量都来自于燃煤发电,由此导致CO2排放量长期居高不下。相较于另外2种碳捕集方法,燃烧后捕集技术工艺成熟、应用较广泛,适用于大多数火力发电厂、合成燃料厂和石化天然气处理厂等,实际应用意义较大。常规CO2燃烧后捕集技术分为吸附分离法、吸收分离法、膜分离法、低温蒸馏法等。
固体吸附剂作为CO2捕集材料之一,成为时下的研究热点[5]。优点在于其工作温度范围相对较广(室温~900 ℃),且在循环利用流程中产生的废弃物较少,使用过的吸附材料易处理,对环境危害相对较小。特别是对于燃煤电厂排放的高温烟气来说,可使用高温固体吸附材料直接进行CO2的捕集,而无须对高温气体进行冷却降温处理,能够避免能量损失,最终达到节省能源、降低生产成本的目的。根据反应机理的差异,可将固体吸附剂分为物理吸附剂和化学吸附剂。另外,依据CO2捕集时的工作温度区别,又将其归类为低温吸附剂(<200 ℃)、中温吸附剂(200~400 ℃)及高温吸附剂(>400 ℃)[6]。
1 低温固体吸附剂
1.1 固体胺吸附剂
传统的通过胺水溶液吸附和汽提去除烟气中CO2的方法存在腐蚀性强、工艺设备去污难和再生能耗高等一系列固有的问题,为了避免上述问题,众多学者对有机胺负载在某些载体材料上的固体吸附剂进行了深入研究,与胺水溶液相比,这些固体吸附剂通常具有成本低、气体回收压力低和再生能耗低等特点[7]。固体胺吸附剂通常在低CO2分压(0.010~0.015 MPa)、低再生温度(<100 ℃)条件下仍可表现出较高的吸附容量,对设备腐蚀性较低。固体胺基吸附剂上的氨基基团可与CO2分子相互作用,生成氨基甲酸、氨基甲酸酯和碳酸氢盐等,从而实现对CO2的捕集。吸附物种的物理化学性质受到胺负载量、胺种类、胺位密度以及胺分子大小的影响。将胺负载到载体上的方法通常包括物理浸渍法、化学接枝法和原位聚合法等。DUTCHER等[7]总结了部分文献中固体胺基吸附剂的CO2平衡吸附容量,见表1。此技术的吸附动力学对于吸附剂的设计研发、反应器的设计开发以及工艺优化具有重大意义。固体胺基材料吸附CO2通常包含4个速率控制步骤,包括:① CO2从气相到吸附剂颗粒表面的外扩散过程;② CO2在吸附剂颗粒孔道的内扩散过程,③ 通过与吸附位点的物理或化学相互作用在表面吸附CO2;④ CO2通过胺/产物层的扩散过程。国内外科研工作者针对胺吸附CO2的动力学过程建立了各类吸附模型,如孔扩散模型、半经验模型、颗粒尺度动力学吸附模型、缩核模型、固体扩散模型和两阶段模型等[8]。
表1 一些固体胺基吸附剂在干燥条件下的CO2平衡吸附容量[7]
Table 1 Equilibrium capacity of some solid amine-based CO2 sorbents under dry conditions[7]
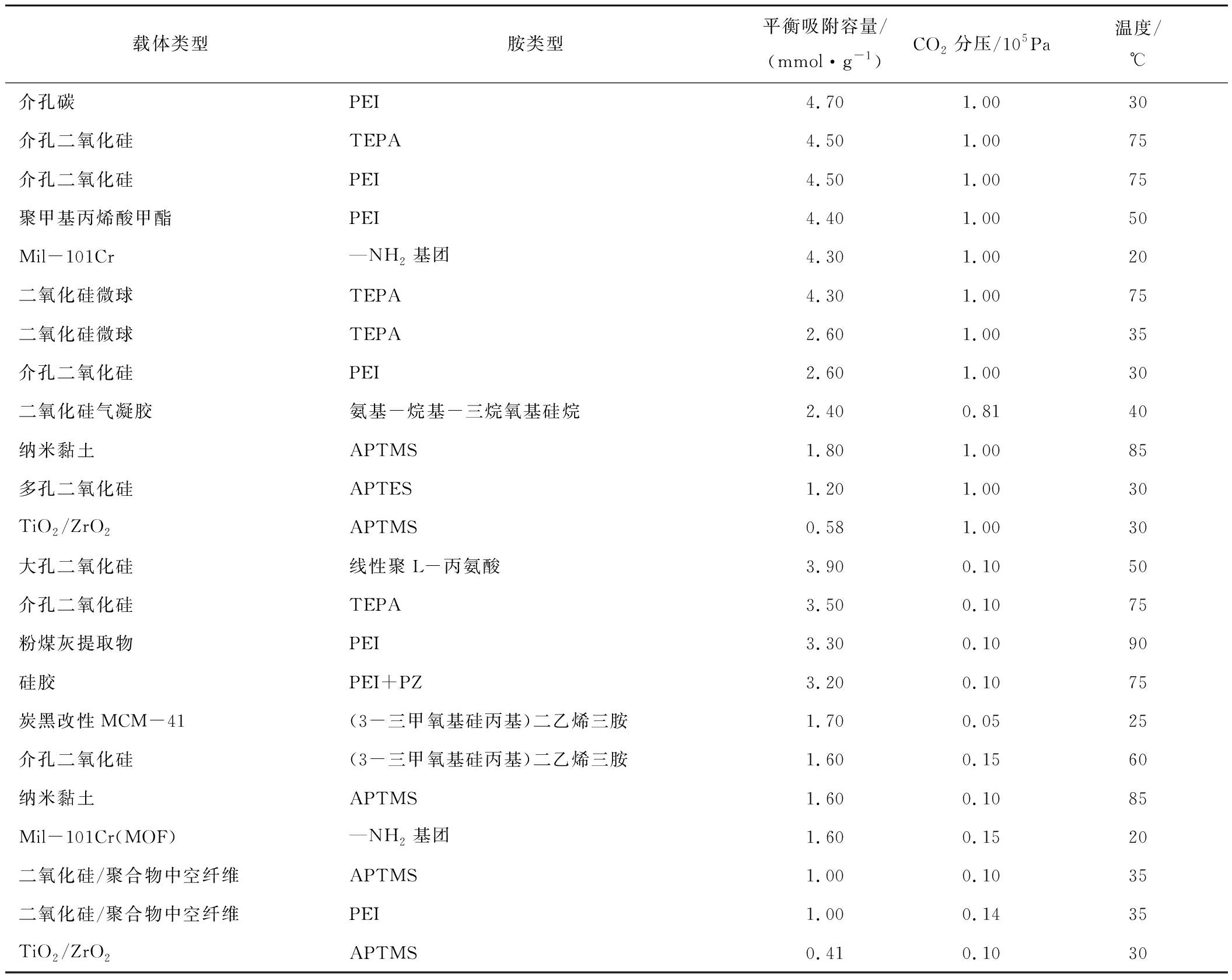
载体类型胺类型平衡吸附容量/(mmol·g-1)CO2分压/105Pa温度/℃介孔碳PEI4.701.0030介孔二氧化硅TEPA4.501.0075介孔二氧化硅PEI4.501.0075聚甲基丙烯酸甲酯PEI4.401.0050Mil-101Cr—NH2基团4.301.0020二氧化硅微球TEPA4.301.0075二氧化硅微球TEPA2.601.0035介孔二氧化硅PEI2.601.0030二氧化硅气凝胶氨基-烷基-三烷氧基硅烷2.400.8140纳米黏土APTMS1.801.0085多孔二氧化硅APTES1.201.0030TiO2/ZrO2APTMS0.581.0030大孔二氧化硅线性聚L-丙氨酸3.900.1050介孔二氧化硅TEPA3.500.1075粉煤灰提取物PEI3.300.1090硅胶PEI+PZ3.200.1075炭黑改性MCM-41(3-三甲氧基硅丙基)二乙烯三胺1.700.0525介孔二氧化硅(3-三甲氧基硅丙基)二乙烯三胺1.600.1560纳米黏土APTMS1.600.1085Mil-101Cr(MOF)—NH2基团1.600.1520二氧化硅/聚合物中空纤维APTMS1.000.1035二氧化硅/聚合物中空纤维PEI1.000.1435TiO2/ZrO2APTMS0.410.1030
CHOI等[9]通过环境大气模拟(400×10-6 CO2)以及仿照火电厂烟气(10% CO2)的气体环境来探究负载型固体胺吸附材料的CO2吸附效率。在CO2浓度降低至原来的1/250后,负载SiO2的胺基吸附剂的CO2吸附性能并无明显变化。聚合胺的共价结合使其在CO2吸附/脱附过程中显示出良好的循环再生性能。DRIESSEN等[10]设计了一种多级流化床装置并将其用于深度分离CO2,同时利用商业胺吸附剂(主链为聚苯乙烯,其中8%~10%为二乙烯基苯,且主链通过苄胺侧基官能化)参与了一系列测试。结果证明该化学吸附路径下胺基吸附材料表现出优异的表观吸附动力学性能,在一个大气压下仍能达到3×10-6的CO2捕集效率(吸附条件:28~63 ℃,CO2物质的量分数为2.5×10-3~10.0×10-3,30 min;脱附条件:100 ℃、100% N2、14 min)。
1.2 碳基吸附剂
碳材料(碳纳米管、活性炭及活性炭纤维等)是一类应用广泛的吸附材料,其通常具有较高的比表面积、发达的孔隙结构及独特的表面化学性质,可通过物理或化学手段引入有机基团来改善物化特性,是最适合作为分离/净化吸附剂的材料之一[11]。但由于CO2在碳基材料表面的作用形式是物理吸附,吸附能力相对较弱,且对温度较为敏感,导致CO2选择性低。为进一步提高碳基吸附材料的CO2吸附量,研究者致力于通过探究吸附剂颗粒形状和孔结构的定量影响、N掺杂、胺改性、氧化氟化等表面改性来调变合成碳基杂化材料。此外,通过在合成过程中调整前驱体材料与制备工艺,可调变吸附剂表面的亲水性/疏水性位点,使其适用于潮湿环境下CO2的吸附分离。
碳基吸附材料的再活化可通过变温吸附或变压吸附来实现,即降压或升温[12]。如通过气体受热膨胀使CO2从吸附剂中脱附出来,随后通过N2吹扫收集CO2。以往多数研究是将CO2平衡吸附容量视为评价碳基吸附剂吸附性能的指标,但从实际应用角度出发,证明工作容量更适用于衡量吸附剂的吸附性能,即在整个吸脱附循环(从低温、低纯气氛到高温、高纯气氛)过程中CO2的实际吸附量。如RAGANATI等[13]通过建模(分析CO2吸附等温线),在25~125 ℃及CO2分压为5.07×103~1.52×104 Pa的条件下,在流化床反应器中对一种市售活性炭进行了CO2工作容量的评价试验。结果表明,升温或减小CO2分压会对吸附热力学产生负面影响。YUE等[14]通过K2CO3活化、尿素改性及椰子壳碳化合成了多孔氮掺杂碳基吸附剂,在固定床测试试验中分别于25 ℃和0 ℃、0.1 MPa条件下得到的CO2吸附量分别为3.7 mmol/g及5.1 mmol/g(脱附条件:100 ℃、100% N2、1 h),在模拟烟气条件下显示出较高的动态CO2吸附能力。迄今为止,已将许多金属氧化物 (包括NiO、CuO和MgO) 掺杂或负载在碳材料上,以进一步提高其CO2捕集能力,但效果有限,需进一步研究以扩大该类型材料的实际应用前景。
1.3 沸石类吸附剂
现如今,燃煤电厂作为CO2的集中排放源,降低碳排放量极其重要。排放的烟道气以体积分数计算,最主要的烟气成分是N2(70%~75%),剩下为CO2(15%~16%)、H2O(5%~7%)和O2(3%~4%),总压强约为0.1 MPa,温度为40~60 ℃[15]。在此压力及温度条件下,沸石类吸附剂可用作性能优良的固体吸附材料,其作为一种成本低廉、高度稳定性的多孔材料,通常可广泛用于工业过程中的气体分离[16]。部分沸石类材料在催化和气体分离领域中的应用情况见表2。沸石作为一种三维高度有序且具有丰富孔道的结晶硅铝酸盐,具有均匀分布的孔径尺寸,且内部形成相互联结的孔道或呈笼型结构,有利于气体分子的扩散。然而沸石的CO2吸附容量受温度和压力的影响较大,如升温时其吸附性能会显著降低。此外,气流中存在的水蒸气也会使其CO2吸附容量快速减小。一般来说沸石类材料通过较强的双配位作用或离子-耦合作用来固定碳酸盐物种,从而实现对CO2的捕集。
现阶段,针对沸石类材料CO2吸附容量的提高主要通过以下3个方面实现:调节沸石框架的组成与结构、沸石材料的阳离子交换与沸石的纯化。BORUBAN和NALBAN[18]通过使用浸渍法在Y型沸石上分别制备了球形(直径约为18 nm)和针形(长度约450 nm)2种不同形貌的氧化铜(CuO)纳米颗粒,并在自搭建的简易玻璃柱反应器中进行了定量分析,证明了CuO纳米颗粒在吸附剂表面形成的这2种形貌都有利于提高其CO2吸附性能。在0.1 MPa和298 K的条件下,与未进行形貌调控的Y型分子筛相比,球形与针形CuO纳米粒子的结构使得对应的吸附材料的CO2吸附容量分别增加了86%和112%。MURGE等[19]以稻壳废弃物为前驱体材料制备了四乙烯五胺改性的沸石基吸附材料,在吸附温度30 ℃、硅铝比2.25及模拟烟气气氛的条件下于固定床反应器中进行了CO2吸附性能测试,所制沸石样品在常压和0.5 MPa压力下分别表现出每克吸附剂吸附114和190 mg的CO2吸附容量,经过20个循环操作后,CO2吸附容量仅下降了2.5%。
表2 沸石类材料在气体分离和催化领域中的应用[17]
Table 2 Application of zeolite-based materials in gas separation and catalysis[17]

材料类型应用亲水性分子筛X型分子筛CO2捕集、空气分离、生产生物柴油A型分子筛氢气净化、脱水、柴油裂解RHO型分子筛空气分离、甲醇和氨反应制二甲胺疏水性分子筛硅酸盐石蜡分离、丙酸气相酮化SSZ-13碳氢化合物分离、NOx还原ZSM-5二甲苯分离、碳氢化合物相互转化、芳香族化合物烷基化硅铝磷酸盐SAPO-56CO2捕集、碳氢化合物催化裂解、甲醇制烯烃SAPO-34CO2-H2、N2-H2分离、碳氢化合物催化裂化、甲醇制烯烃AlPO4sCO2捕集、制备异戊二烯
1.4 MOFs类吸附剂
金属-有机框架(Metal Organic Frameworks,简称MOFs)材料的CO2捕集能力常与沸石类材料进行对比。MOFs材料是一类由有机桥联配体和无机团簇组成的多孔晶体材料,其作为吸附剂可与CO2选择性结合[20]。当MOFs中含有能与CO2气体分子相互作用的不饱和金属吸附位点(如不饱和的开放式金属吸附位点、极性官能团及金属团簇)时,其在低压条件下即可表现出极强的CO2吸附性能。但该类材料存在局限性,表现为烟气中存在的水分会在CO2捕集中产生竞争吸附,水的竞争吸附不但会降低MOFs吸附剂的工作效率,还会增加其再生能耗。此外,MOFs材料较低的水热稳定性是限制其工业CO2捕集的另一个局限性。气流中存在的水分会水解MOFs的配位键,并与CO2产生竞争吸附,导致CO2吸附性能下降。为了克服水分对MOFs材料分离CO2的消极影响,可在MOFs的纳米孔道中增加胺基化学吸附位点来增强CO2/H2O的吸附选择性。此外,还可通过赋予MOFs疏水性来减弱其与水之间的相互作用,以削弱水的竞争性吸附[21]。
通过将各类亲CO2基团接枝到MOFs材料的孔表面可对其实现改性处理,如烷基胺的添加可有效极化MOFs框架表面。HU等[22]成功制备了不同烷基胺改性的MIL-101吸附剂样品,胺基基团由于具备与CO2的强相互作用且难以与N2反应的特点,极大增强了其CO2吸附能力。在热重分析仪测试中MIL-101-二乙烯三胺样品表现出较强的CO2吸附性能、多循环稳定性以及对CO2/N2的超高选择性。LI等[21]制备得到了2种Zr掺杂的纳米MOFs吸附剂UiO-66和UiO-66-NH2,在自搭建填料塔中将其用于选择性吸附分离模拟天然气(CO2/CH4=10/90)和烟气(CO2/N2=15/85)中的CO2。UiO-66-NH2纳米材料具备较小的晶粒尺寸、丰富的缺陷位以及孔道内含有大量NH2基团,显示出最佳的CO2/CH4与CO2/N2选择性吸附性能,且在吸附过程中其对于CO2(0.32 eV)表现出优于CH4(0.2 eV)及N2(0.19 eV)的吸附能。与沸石类吸附剂相比,MOFs类吸附剂在高压下具有较高的捕集容量,但在低压条件下吸附性能较弱。由于MOFs具备良好的结构及热稳定性,且具备CO2吸附的完全可逆性,所以能较好地应用于变压吸附过程中。
1.5 聚合物类吸附剂
直接空气捕集(Direct Air Capture,简称DAC)是实现CO2捕集的一种技术,聚合物类材料在该项技术中具备较强的应用潜力[23]。聚合物类吸附材料一般为富含微孔/介孔的有机物,高孔隙率、可调孔结构、良好的热力学及动力学性能是其作为CO2吸附剂的优势所在[24]。目前,用于捕集CO2的聚合物材料通常包括固有微孔及共轭微孔聚合物 (CMPs)、多孔性三聚氰胺甲醛 (MF)、多孔芳香框架聚合物 (PAFs)、超交联聚合物 (HCPs)、具有共价三氮基框架的聚合物 (CTFs)以及共价有机聚合物 (COPs)等[25]。一方面可通过后修饰的方法引入新的功能化基团,如羧酸、羟基、金属卟啉单元等提高这些材料对CO2的吸附活性与效率;另一方面可通过引入一些电负性、碱性分子或富氮基团,如三嗪类、咪唑类、亚胺类,提高其与CO2的相互作用,从而增强吸附性能。
WANG等[25]将聚乙烯亚胺作为载体,于油包水溶胶中合成了相互连接且高度均匀的大孔聚合物吸附剂。这种合成方法的特点在于通过利用双表面活性剂在乳液中加入水溶胶来实现油包水溶胶的制备。纳米级的聚集体可以包围微米级的水溶胶液滴,使得该材料具有均匀分布的孔径和三维连通的孔道,并且均匀互连的大孔结构有利于CO2的扩散。烟气温度75 ℃下于磁悬浮天平及热重分析仪中进行吸附性能及吸附动力学测试,吸附剂样品对纯CO2以及10% CO2/N2的CO2的吸附量分别为5.6和4.5 mmol/g(吸附条件:75 ℃、1 h;脱附条件:110 ℃、抽真空、1 h)。ARMSTRONG等[26]将含有电纺致密纤维、电纺多孔纤维以及离子交换树脂(IER)的工业薄膜作为电纺支架,并利用溶剂热聚合物当作添加剂来提高样品孔隙率,制备得到了静电纺丝聚合物/吸附剂复合物。性能最佳的吸附剂样品对CO2捕集效率为每克吸附剂每小时吸附1.4 mol CO2,其吸附半衰期为(10±3)min,具备良好的稳定性。ZHU等[27]通过ZnCl2催化离子热聚合法制备得到了具备不同阴离子(SCN-和Cl-)的联吡啶基离子共价三嗪骨架(ICTFs),并在热重分析仪中进行了CO2吸附性能的测试,由于CO2气体分子与联吡啶单元的电荷中心能够产生静电相互作用,使得离子能够紧密地吸附在电负性气体中,因此ICTFs的离子特性明显增强了其CO2吸附性能。总之,多孔聚合物由于其高比表面积和合成多样性而在低温CO2捕集/分离方面有较大优势。改善多孔聚合物基吸附材料的CO2捕集性能可分为以下3个方面:① 调节聚合物骨架的组成;② 改变多孔聚合物的孔径和比表面积;③ 对聚合物进行表面改性,包括引入COOH、NH2、P![]() O、P
O、P![]() S、SO3Li、SO3H、Li等各种基团。为了进一步工业化应用,目前应克服2个技术问题:提高吸附剂的水热稳定性以及增强其吸附/脱附循环再生性能。
S、SO3Li、SO3H、Li等各种基团。为了进一步工业化应用,目前应克服2个技术问题:提高吸附剂的水热稳定性以及增强其吸附/脱附循环再生性能。
1.6 其他低温固体吸附剂
石墨/石墨烯类吸附材料的主要成分是碳的同素异形体,各类碳杂化类型的石墨烯以及石墨纳米带具备不同的化学活性[28]。如由sp2杂化碳原子构成的纳米带蜂窝晶格的表面具有化学惰性,存在未配对电子,故对于多层石墨烯纳米,其化学活性大大加强。石墨不但与碳类吸附剂同样具有相似的化学特性,生产成本也较低,因此大量的改性石墨/石墨烯类材料与石墨烯-无机杂化吸附剂被合成用作CO2吸附材料。
二氧化硅具有高比表面积、大孔容、孔径分布均匀、再生稳定性好等优点,其主要用作载体、并通常引入胺基以捕获CO2。因此,对硅基吸附剂的研究主要集中在制备不同类型的二氧化硅(硅粉、二氧化硅空心球、二氧化硅纳米管、二氧化硅纳米粒子、多孔硅泡沫、大孔二氧化硅、气凝胶等)以及选择合适的胺基[29]。由于载体占整个吸附剂制备成本的90%以上,因此探究性价比高及商业上可行的多孔二氧化硅材料成为研究热点。
黏土是黏土矿物以及含有少量金属氧化物与有机物的黏土矿物组合的总称,主要由层状硅酸盐矿物构成,通常在矿物结构中保留了不同含量的水分。黏土作为固体吸附材料,具有制备成本低廉、高比表面积、高力学性能和化学稳定性、高再生性、高产量等优势。近年来利用黏土材料进行CO2捕集引起了广泛关注,现阶段用于分离脱除CO2的黏土类吸附剂主要包含蒙脱石和膨润土等材料[30]。
以Na2CO3和K2CO3 作为代表的碱金属碳酸盐因具有高吸附量和低成本等优势同样可用于吸附分离CO2[31]。该类材料的吸附温度通常在50~100 ℃,CO2脱附温度通常在120~200 ℃。但是碱金属碳酸盐吸附剂的局限性在于其碳酸化反应速度较慢,且耐久性差,工作温度易受限。学者们尝试在活性炭、氧化铝、二氧化硅、二氧化钛、氧化锆、氧化镁、金属箔等载体上均匀分散活性Na2CO3/K2CO3物种来解决上述问题,提高了耐磨性。
1.7 低温固体吸附剂小结
对于低温固体吸附剂来说,通常情况下高压条件更有利于其吸附CO2,但对气体的选择性较低,且受水蒸气影响较大,气流中存在的水分会水解某些吸附剂(如MOFs类材料)中的配位键,并与CO2产生竞争吸附,导致CO2吸附性能下降。如活性炭、分子筛类材料一般具有较高的热稳定性以及一定的机械强度,但其对于CO2的选择性相对较差,且低压下的吸附能力较弱,此外烟气中的水汽会影响其对CO2的吸附,各类低温固体吸附剂的优缺点见表3。近年来学者们致力于合成出吸附容量大、稳定性高、循环使用性能好的低温固体吸附材料。
表3 低温固体吸附剂优缺点
Table 3 Advantages and disadvantages of various low-temperature solid sorbents

吸附剂类型优点缺点固体胺吸附剂 低CO2分压、低再生温度下仍具有较高的吸附容量,对设备腐蚀性较低,成本低、气体回收压力低和再生能耗低 CO2向活性位点的扩散易受限,多次再生过程中胺易流失碳基吸附剂 具有较高的比表面积、发达的孔隙结构及独特的表面化学性质 作用形式属物理吸附,吸附能力相对较弱,对温度较为敏感,CO2选择性低沸石类吸附剂 孔径分布均匀,内部形成互相联结的孔道或笼型结构,利于气体分子扩散 温度较高或有水蒸气存在时CO2吸附容量会显著下降MOFs类吸附剂高比表面积、发达的孔隙结构、结构可调性、种类丰富等 遇水或水蒸气不稳定,且在酸性或碱性条件下亦难以保持稳定聚合物类吸附剂结构易修饰、质量轻、高热稳定性和化学稳定性水热稳定性相对较差
2 中温固体吸附剂
2.1 类水滑石衍生吸附剂
层状双金属氢氧化物(Layered Double Hydroxides, LDHs)可用作中温固体吸附材料,由于其具备快速的吸附/脱附动力学以及再生性能较高而备受关注,LDHs材料适用于从发电站或大气中捕集CO2,且能利用可持续能源(如阳光)将其转化为燃料利用。对于LDHs类材料来说,其较高的CO2分子亲和力以及较大的比表面积有利于CO2在光照条件下的选择性分离与转化[32]。
LDHs也可称为类水滑石化合物(HTlcs)或阴离子型黏土,结构包含二价/三价阳离子,其通式为![]() 其中M2+为二价阳离子;M3+为三价阳离子;x取值在0.20~0.33,即金属离子M3+的物质的量分数;An-为层间阴离子。LDHs无机层及层间阴离子的化学成分可以精确调控。LDHs材料的结构为典型的八面体单元,其经过热处理后,可转变为具有不规则3D网络的非晶态/亚稳态金属氧化物(MMO)。此外,LDHs的初始层状结构也能通过溶液中的阴离子插层或直接暴露于潮湿环境中来恢复原貌。
其中M2+为二价阳离子;M3+为三价阳离子;x取值在0.20~0.33,即金属离子M3+的物质的量分数;An-为层间阴离子。LDHs无机层及层间阴离子的化学成分可以精确调控。LDHs材料的结构为典型的八面体单元,其经过热处理后,可转变为具有不规则3D网络的非晶态/亚稳态金属氧化物(MMO)。此外,LDHs的初始层状结构也能通过溶液中的阴离子插层或直接暴露于潮湿环境中来恢复原貌。
LDHs类材料一般具有较为丰富的碱性位,其在200~400 ℃内可与CO2气体产生化学反应作用。通常来说,较小的晶粒尺寸、较大的比表面积与较为疏松多孔的形貌结构有利于LDHs衍生吸附材料活性位的暴露,从而使得更多的CO2与之发生反应,最终吸附剂的CO2捕集性能得以提高。但其独特的氢键堆积结构限制了其吸附容量进一步提高。KOU等[33]采用简单的溶剂热法,制备了一系列不同Mg/Al物质的量比的多孔MgAl-CO3-LDHs复合氧化物,并将甲醇作为改性试剂,用以取代MgAl-CO3-LDHs的层间水分子,能有效提高吸附材料样品的比表面积和孔隙率,其在热重分析仪中进行300 h吸附/脱附循环过程后(100个循环),CO2吸附量仍能达到1.7 mmol/g,显现出了良好的吸附性能(吸附条件:200 ℃、50% CO2/50% N2、60 min;脱附条件:400 ℃、100% N2、30 min)。ZHU等[34]利用水溶性有机溶剂处理的手段,将LDHs前驱物浸入质量分数20%的K2CO3溶液,合成了具有花状纳米片形貌的Mg3Al-CO3(LDH)吸附材料。此外,分别用乙醇及丙酮作为改性剂来处理样品,使其能够暴露出更多的内层活性位点,使样品比表面积分别达到287和212 m2/g。结果表明,K+可在吸附剂表面均匀分散,提高了表面改性效率。与此同时,煅烧过程中释放出的乙二醇优化了吸附剂的孔结构。在热重分析仪中测试了样品CO2吸附性能,经10次吸附/脱附循环后其吸附量仍能达到1.2 mmol/g(吸附条件:400 ℃、100%CO2、60 min;脱附条件:450 ℃、100% N2、60 min)。
2.2 MgO基吸附剂
MgO在地球土壤中储量丰富且成本较低,作为CO2固体吸附材料具有理论吸附容量高(每克吸附剂1 100 mg CO2)、无毒、适用范围较广及工作温度范围大(室温~400 ℃)等优势。在相对干燥的反应条件下,MgO吸附剂对CO2的吸附机理为
MgO(s)+CO2(g)![]() MgCO3(s)。
MgCO3(s)。
(1)
在此过程中CO2首先与MgO颗粒反应生成MgCO3产物层,未反应的MgO颗粒被包裹其中,之后CO2通过扩散作用穿过产物层继续与MgO发生反应。在存在水蒸气的反应条件下,MgO首先与H2O反应形成中间产物MgO·H2O*,随后与CO2反应生成最终产物MgCO3。但是MgO吸附剂在实际应用中同样也存在局限性,由于缺少基础活性位点以及固有的高晶格焓,致使其多循环吸附动力学表现不佳[35]。据文献报道,商业MgO材料的CO2吸附容量在多个吸附/脱附循环过程中会降低到每克吸附剂10~20 mg CO2。导致这一问题的原因主要有2个方面:① 比表面积较小(商业MgO的比表面为8~35 m2/g),使其无法暴露出足够的吸附活性位点;② 该反应过程的最终产物层MgCO3的产生会引发吸附剂体积膨胀(相比反应前增大了约2.5倍),致使相邻的碱性位被覆盖,最终降低其CO2捕集性能。
为了提高MgO基吸附剂对CO2的捕集容量,国内外学者提出了各类解决方案,包括制备介孔MgO、在多孔载体上均匀负载MgO、碱金属碳酸盐/硝酸盐掺杂、制备MgO基混合氧化物以及微观结构改性处理等。GUO等[36]以MgCl2·6H2O作为前驱物对几类生物质废弃物材料(咖啡渣、甘蔗渣、锯末、稻壳等)采取了先预处理后煅烧的方法,合成了一系列负载型MgO基吸附材料。其中,稻壳灰负载的吸附剂具备较高的MgO颗粒结晶度、良好的纳米孔结构、表面碱度的富集以及活性组分的均匀分散性等特性。当MgO的负载量为质量分数20%时,该样品在固定床反应器中的CO2初始吸附容量达到了每克吸附剂4.6 mmol CO2,并且10次吸脱附循环后其吸附容量损失率仅为7.68%(吸附条件:200 ℃、10%CO2/90%N2;脱附条件:400 ℃、100%N2)。JEON等[37]合成了MgO-Al2O3共晶复合氧化物材料,并研究了其碳化机理。该吸附剂表面生成的MgCO3产物层与MgO-Al2O3界面构成三相界面,引导CO2在MgO活性位点上共同形成蘑菇状的MgCO3,该MgCO3产物沿吸附剂表面均匀分散,并随着CO2吸附/脱附过程的持续进行而纵向演化,能够避免产物以团聚形式存在,从而使吸附剂样品的CO2捕集容量得以最大程度保留。
2.3 中温固体吸附剂小结
类水滑石衍生吸附剂通常具有较大的比表面积,且可均匀分散吸附活性物种,从而暴露出更多的吸附位点,最终实现其与CO2气体分子之间最大程度的相互作用以增强CO2捕集能力。MgO基吸附剂可适用于甲醇蒸汽重整制氢或吸附增强的水煤气转化反应等过程中,该吸附剂能够有效移除CO2副产物,从而促进反应朝正向进行,应用前景广阔。但类水滑石材料有独特的氢键堆积结构,而MgO则缺少基础活性位点以及具备固有的高晶格焓,其自身性质导致了该类吸附剂的CO2吸附性能均相对较差,因此在实际工况下的规模化应用受到限制,这2种吸附剂的优缺点见表4。未来研究重点在于继续优化制备工艺,研发出绿色低廉、简易高效的类水滑石衍生吸附剂以及MgO基吸附剂。
表4 中温固体吸附剂优缺点
Table 4 Advantages and disadvantages of medium-temperature solid sorbents

吸附剂类型优点缺点类水滑石衍生吸附剂 具有丰富的碱性位、较小的晶粒尺寸、疏松多孔的形貌结构以及较大的比表面积,有利于吸附活性位的暴露CO2吸附容量相对较低MgO基吸附剂理论吸附容量较高、适用范围广、无毒以及工作温度区间大吸附速率相对较慢
3 高温固体吸附剂
3.1 锆酸盐基吸附剂
锆酸锂(Li2ZrO3)材料是一类高温CO2固体吸附剂,其与CO2的反应机理[38]为
Li2ZrO3(s) + CO2(g)![]() ZrO2(s) + Li2CO3(s)。
ZrO2(s) + Li2CO3(s)。
(2)
Li2ZrO3在碳捕集过程中体积变化小,但存在一定的吸附动力学局限性,影响其进一步应用,可通过以下方式解决:① 改变吸附剂晶体结构;② 引入Na+或K+替代部分Li+来提高Li2ZrO3基吸附剂的CO2吸附性能。
研究人员对Li2ZrO3基吸附剂的吸附动力学进行了建模研究,以便了解CO2的吸附/脱附过程。模拟结果表明,表面反应是控制反应动力学的主要因素,而产物层扩散阻力对吸附过程的影响较小[28]。进一步研究发现,在500~700 ℃进行1 h碳酸化/煅烧反应后,只有体积分数11%~13%的CO2被吸附。由于多数情况下CO2的吸附都发生在反应动力学控制阶段,而不是扩散控制阶段,所以Li2ZrO3吸附剂较为缓慢的吸附动力学限制了其在工业生产中的应用。除了作为固体吸附剂,Li2ZrO3还可用于镍基催化剂推动的甲烷重整反应中,通过分离产物中的CO2可提高H2的生产效率[39]。
除Li2ZrO3外,Na2ZrO3也可作为CO2吸附剂。在600 ℃下,比Li2ZrO3表现出更高的CO2吸附性能。这归因于Na2ZrO3具备更加良好的CO2吸附动力学。但Na2ZrO3吸附剂有再生能力较差的缺点,多个吸附/脱附循环后吸附剂会产生严重的失活现象[39]。
3.2 硅酸盐基吸附剂
部分硅酸盐材料也可作为高温固体吸附剂进行CO2的捕集[28]。近些年,研究人员制备出了一系列碱硅酸盐吸附材料,包括Li4SiO4、Li4-xNaxSiO4、Li4+x(Si1-xAlx)O4、Li4-x(Si1-xAlx)O4、Li8SiO6、Li6Si2O7、Li2Si2O5、Li2Si3O7、Na2SiO3、Ca2Si2O3和(OH)3Al2O3SiOH等。其中,Na2SiO3等材料由于CO2吸附性能较差(通常小于质量分数10%)而关注度相对较低。正硅酸锂(Li4SiO4)作为高温CO2吸附剂的主要优势在于具备较低的再生温度(<750 ℃)、较高的CO2捕集容量(理论数值为每克吸附剂0.367 g CO2)与极佳的循环稳定性,其CO2捕集容量经多次吸附/脱附循环过程而无明显变化。Li4SiO4作为高温CO2吸附剂的反应机理[38]为
Li4SiO4(s)+CO2(g)![]() Li2SiO3(s)+Li2CO3(s)。
Li2SiO3(s)+Li2CO3(s)。
(3)
Li4SiO4基吸附剂除了可用于火力发电厂烟气和燃气轮机废气中CO2的捕集外,还可用于水煤气变换反应(WGS)和蒸汽甲烷重整反应(SMR)中CO2的脱除。此类反应温度通常在450~600 ℃,CO2体积分数在4%~20%,在这些条件下,CO2吸附过程中的动力学限制是Li4SiO4吸附剂实现工业应用的主要障碍[40]。Li4SiO4基吸附剂对CO2的吸附过程以表面化学反应为主,通常可采取以下方式改善其性能:① 通过增大吸附速率以及延长吸附时间来强化化学反应控制阶段;② 增大扩散控制阶段的吸附速率。整体来说,这些手段包括:微观结构改性、碱掺杂、过渡金属掺杂、硅源和锂源的有效利用、碱土金属掺杂。
Li4SiO4吸附剂材料最初于2002年制备合成,近年来国内外科研人员做出了大量的努力,通过探究反应机理、调变操作参数、优化合成过程等来提高Li4SiO4吸附剂的CO2捕集能力,设计研发适合工程应用、性能较优异的Li4SiO4吸附剂。BUELENS等[41]合成了3种不同的正硅酸锂(Li4SiO4)吸附材料,分别为:① Li4SiO4;② 带有氧化锆涂层的Li4SiO4,记为Li4SiO4@ZrO2;③ 带有锆酸锂涂层的Li4SiO4,记为Li4SiO4@Li2ZrO3。使用一系列表征手段,发现性能最佳的样品为Li4SiO4@Li2ZrO3,其富含锂组分的核壳结构能够使其经过碳酸化过程后更易于重组,历经脱碳过程后可快速再生。Li4SiO4@Li2ZrO3吸附剂样品较高的吸附量、优异的多循环稳定性及快速CO2吸附/脱附动力学有利于其应用于工业CO2捕集过程。STEFANELLI等[42]制备得到了碳酸钾(K2CO3)改性处理的正硅酸锂(Li4SiO4)吸附材料,并在不同CO2分压(4.05×103~5.07×104 Pa)和温度(540~580 ℃)下研究了CO2捕集能力。通过建立缩核模型,证实粉末状及颗粒状样品的试验数据在该反应温度及CO2分压范围内都表现出较好的拟合度。研究发现,K2CO3的添加使得样品在碳酸化反应阶段形成了(K/Li)-CO3共晶化合物,增大了中低CO2分压下产物层的扩散速率(吸附条件:540~580 ℃、120 min;脱附条件:660 ℃、100% N2,直至样品失重率<0.1%/min)。
3.3 CaO基吸附剂
3.3.1 CaO基吸附剂概述
工业生产中用于CO2分离脱除较为成熟的技术是胺基吸收技术,该技术工作温度为40~150 ℃。然而胺吸收剂再生能耗通常较高、工艺成本难以降低,设备易受腐蚀,且循环过程中易生成废弃物,导致环境污染。虽然沸石、活性炭以及碳纤维等微孔/介孔材料也能在低温条件下吸附CO2,但由于其存在吸附动力学的局限性,该类材料不适用于300 ℃以上的温度环境,限制了其在合成气/制氢等工艺过程中的应用(废气温度一般超过500 ℃)。相比之下,氧化钙基固体吸附材料作为一种高温吸附剂具有价廉易得、吸附容量较高、吸附速率较快、环境友好以及低毒等优势。特别是对于燃煤电厂产生的高温烟道气来说,无须将气体冷却,可使用钙基吸附剂直接捕集CO2,降低整体成本,避免能量损失[39]。CaO吸附CO2的反应机理如下:
CaO(s)+CO2(g)![]() CaCO3(s)。
CaCO3(s)。
(4)
图1为钙循环捕集CO2的工艺流程示意,CaO颗粒与进料气体中的CO2在碳酸化炉中于600~700 ℃反应生成CaCO3,随后CaCO3通过旋风分离器分离,并经气流送入煅烧炉经850 ℃以上的温度再生,得到的CaO继续进入碳酸化炉中进行后续的CO2吸附/脱附循环过程。

图1 钙循环工艺流程示意[43]
Fig.1 Schematic sketch of the typical calcium looping process[43]
CaO颗粒CO2吸附过程的快速反应阶段主要受到样品颗粒表面积的影响,同时还会受到产物(CaCO3)层生长的限制。在CO2扩散控制阶段,CaCO3的形成对表面反应、孔扩散和产物层扩散有重要影响。产物层的生长会使气体在孔隙中的扩散变得更加困难,抑制了气固表面反应的发生。通常烟气成分中还含有少量的SO2,会与CO2产生竞争性吸附,导致钙基吸附剂吸附容量降低。CaO与SO2的硫化反应除了受气体扩散控制外,还受固态离子扩散控制。当碳化产物层与硫化产物层(CaSO4)厚度相等时,碳化反应仅受气体扩散控制,而由于CaSO4具有很高的离子导电性,硫化反应可通过Ca2+和O2-在产物层中从内向外的扩散继续进行,故硫化反应最终可进行的程度比碳化反应更深,相同比表面积的吸附剂硫化率大于碳化率。因此,使用钙基吸附剂对烟气进行CO2捕集前,最好先进行脱硫处理。对CaO基吸附剂的实际应用来说,反应活性的降低主要是由颗粒形貌的改变——团聚烧结引发的,此过程通常是由煅烧时CaO亚晶的生长与杂质微观表面的熔化团聚引起的。微晶的形成通常会导致反应比表面变小,从而使气固反应速率下降。煅烧时,CO2的脱附过程通常发生在较高的CO2分压下,这种高浓度CO2的存在以及苛刻的煅烧条件会加速烧结现象的发生,致使颗粒孔隙率下降,进而造成反应活性显著降低。针对这些问题,国内外科研人员研究采取高温热预处理、水合处理、化学掺杂改性、酸改性等方式来增强其CO2捕集性能与循环热稳定性[44-45],见表5。
表5 增强天然石灰石CO2吸附性能的改性方法及对应CO2吸附测试条件[45]
Table 5 Summary of the typical modification methods for the CO2 capture performance enhancements
of natural limestone and the testing conditions for the obtained sorbents[45]
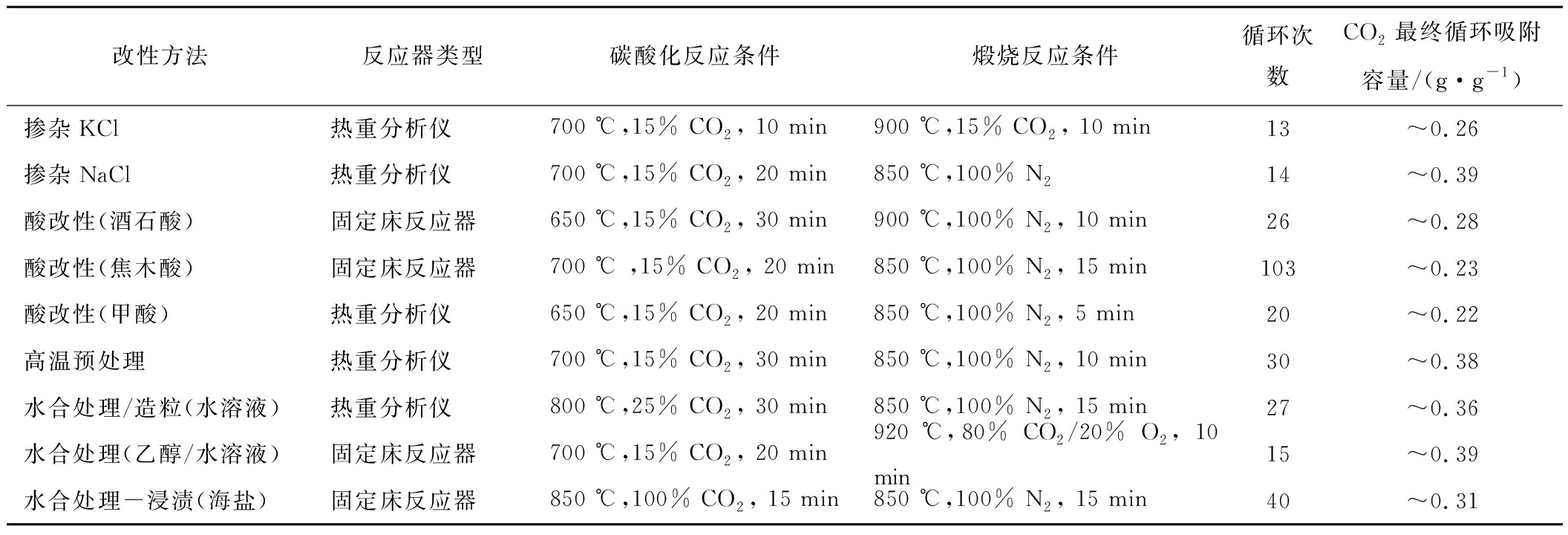
改性方法反应器类型碳酸化反应条件煅烧反应条件循环次数CO2最终循环吸附容量/(g·g-1)掺杂KCl热重分析仪700 ℃,15% CO2, 10 min900 ℃,15% CO2, 10 min13~0.26掺杂NaCl热重分析仪700 ℃,15% CO2, 20 min850 ℃,100% N214~0.39酸改性(酒石酸)固定床反应器650 ℃,15% CO2, 30 min900 ℃,100% N2, 10 min26~0.28酸改性(焦木酸)固定床反应器700 ℃ ,15% CO2, 20 min850 ℃,100% N2, 15 min103~0.23酸改性(甲酸)热重分析仪650 ℃,15% CO2, 20 min850 ℃,100% N2, 5 min20~0.22高温预处理热重分析仪700 ℃,15% CO2, 30 min850 ℃,100% N2, 10 min30~0.38水合处理/造粒(水溶液)热重分析仪800 ℃,25% CO2, 30 min850 ℃,100% N2, 15 min27~0.36水合处理(乙醇/水溶液)固定床反应器700 ℃,15% CO2, 20 min920 ℃,80% CO2/20% O2, 10 min15~0.39水合处理-浸渍(海盐)固定床反应器850 ℃,100% CO2, 15 min850 ℃,100% N2, 15 min40~0.31
1)高温预处理。钙基吸附剂的高温预处理是一种吸附剂再生的手段,该过程中存在热应力能够使吸附剂颗粒发生结构重排,从而硬化/固化颗粒,提高其循环稳定性。CaO吸附剂热预处理进行再生的本质是通过固态相的均匀分散导致其碳酸化作用增强,致使生成的CaO骨架的孔隙率提高,从而在随后的循环过程中能够快速碳酸化。据文献报道,在较高的脱附温度(如800 ℃)以及较低CO2分压下一般可实现对CaO吸附材料的高温热预处理,从而使吸附剂颗粒重新活化再生。VALVERDE等[46]研究了不同气氛条件下的高温预处理过程对石灰石衍生钙基吸附材料吸附特性的影响,在吸附剂合成过程中引入SiO2以缓解晶粒烧结现象的发生。研究结果表明,在高CO2分压、高温条件下对吸附剂进行预处理,会在CO2快速反应控制阶段迅速生成较厚的产物层(CaCO3),阻碍CO2气体扩散过程的发生。相比之下,利用温和的煅烧条件会缓解这一情况,从而使吸附剂样品颗粒得以维持相对较大的比表面积,在多循环吸附/脱附过程中保持良好的CO2吸附能力与热稳定性。
2)水合作用。CaO基吸附剂水合处理的相关概念最早于1980年由阿贡国家实验室提出,此过程中的反应机理[47]为
水化反应:
CaO(s) + H2O(g/l)![]() Ca(OH)2(s),
Ca(OH)2(s),
(5)
脱水反应:
Ca(OH)2(s)![]() CaO(s) + H2O(g)。
CaO(s) + H2O(g)。
(6)
CaO颗粒通过与水/水蒸气发生反应来对内部进行渗透活化,致使颗粒膨胀断裂。而Ca(OH)2产物层扩散阻力的消失提高了CaO与水(或蒸汽)的反应速率,短时间内产生集中的反应热。除此之外,水合作用改变了吸附剂的摩尔性质,Ca(OH)2由于摩尔质量更接近CaO,而其摩尔体积更接近CaCO3,故其密度相对较小。另一方面,在燃烧室/气化炉中加入Ca(OH)2会导致其化学结合水减少,从而使其脱水形成晶粒尺寸更小、比表面积和孔容更大、孔隙率更高、反应活性更强的CaO,从而提高碳酸化转化率。
CaO基吸附剂颗粒的水合处理过程属于反应速率迅速的放热反应过程,而其脱水反应,即Ca(OH)2的吸热分解则需要在420 ℃以上进行。普通的高温反应器(如碳酸化器和煅烧炉)不适合进行吸附剂的水合处理,需要用专门设计的反应器在低温下进行。当温度高于600 ℃时,虽然水合作用仍能发生,但此过程的蒸汽分压通常高达0.4 MPa,致使生产成本上升。另一方面,伴随循环次数和煅烧温度的增加,吸附剂颗粒烧结现象愈发严重,导致其颗粒密度(包括孔隙率)变大。因此,在较低的反应温度和压力条件下利用专门的水合反应器来实现吸附剂的活化再生更加符合工程应用的需求。
3)掺杂改性。通过在CaO基吸附剂中引入惰性/难熔材料(如MgO、Al2O3、La2O3、SiO2、TiO2和ZrO2等)可以增强吸附剂的抗烧结性能。若惰性载体具备高熔点、较好的分散性以及高比表面积等性质,则制备得到的吸附剂会显现出较优异的循环热稳定性。虽然某些氧化物/复合氧化物也可作为独立的吸附材料,但其在CaO与CO2反应的平衡温度及压力条件下难以自发地捕集CO2,所以该类材料的添加量同样需要注意。在钙基吸附剂的制备过程中引入惰性/难熔材料的本质在于,其可在CaO表层/内部产生物理阻隔作用,阻碍CaO晶体的聚集长大,从而减少吸附剂在多循环操作中的烧结现象,如图2所示。
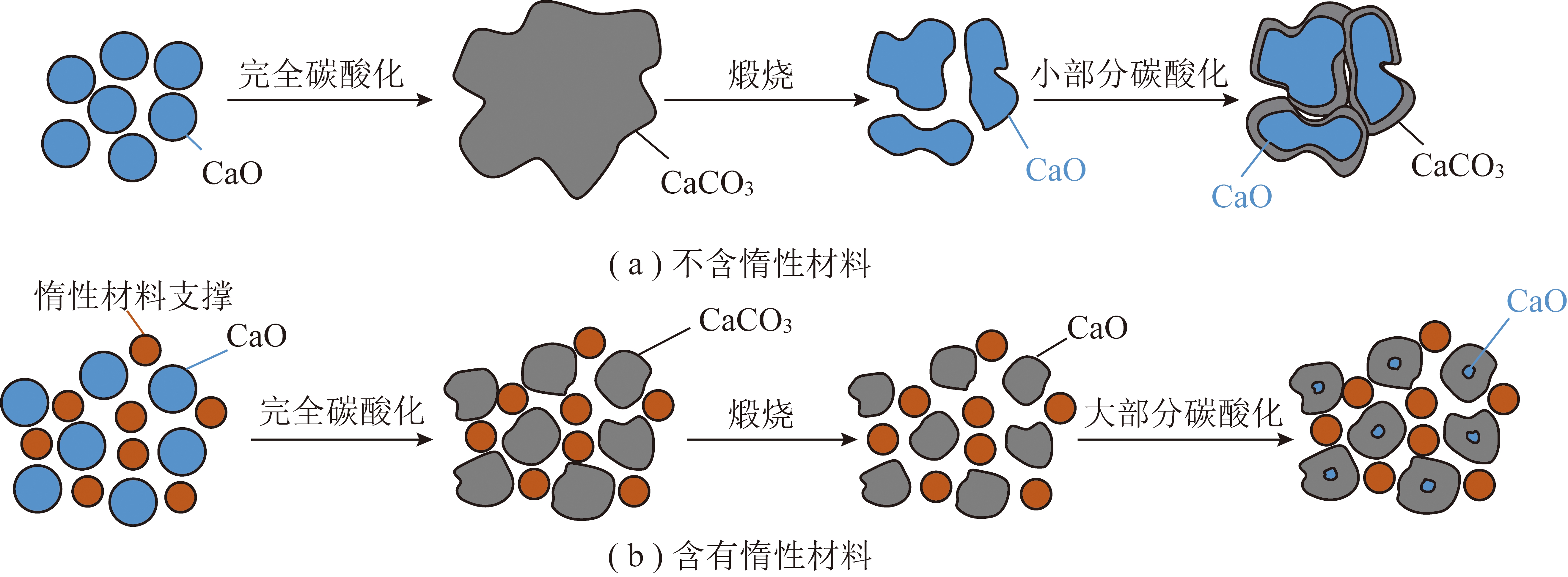
图2 引入惰性材料的强化机制示意[48]
Fig.2 Schematic presentations of the enhancement mechanism by incorporating inert support[48]
大量研究表明,相比于石灰石CaCO3来说,白云石CaMg(CO3)2具备更强的循环稳定性,这是因为白云石中MgCO3含量较高,在多循环的煅烧过程中,可分解为MgO,而MgO可充当惰性掺杂剂,其在吸附剂的碳酸化/煅烧循环过程中能够减缓CaO颗粒烧结。此外,许多其他金属氧化物如Cr2O3、CeO2、CoO、CuO、γ-Al2O3、Mn2O3、SiO2、ZrO2、TiO2、MgO的掺杂特性同样被系统研究。Al2O3的添加通常会在煅烧阶段形成稳定的钙铝复合氧化物(如Ca12Al14O33),可有效增强CaO颗粒的抗烧结特性。
4)酸改性。通过使用乙酸、甲酸等有机酸或HCl、HBr、HI、HNO3等无机酸对CaO吸附剂进行酸处理,可改善吸附剂的多孔性质,从而促进CO2的吸附[49-50]。酸改性试剂先与钙前躯体反应形成有机钙盐。随后在煅烧时,有机钙盐会分解成CaCO3及有机物,CaCO3进一步煅烧产生CaO,有机物则会分解产生大量气体,进而有效改善了吸附剂的孔结构,增加了吸附剂的比表面积,最终提升CO2吸附容量。AL-JEBOORI等[49]分别用4种不同的矿物酸(HCl、HBr、HI和HNO3)对石灰石进行预处理,以改善钙基吸附剂的孔道结构进而提高其吸附性能。结果表明,除HNO3外的其他3种酸均可提高吸附剂样品在13个循环中的CO2吸附容量和长循环稳定性。S NCHEZ等[51]和WANG等[52]分别向石灰石/白云石混合物中添加乙酸(AA)和柠檬酸(CA),用以合成MgO负载的CaO基吸附剂。结果发现,AA及CA的存在可以改善吸附剂的多孔结构,减少孔道堵塞和烧结现象的发生,促进了CO2的扩散效率,最终提升钙基吸附剂的CO2吸附性能。
NCHEZ等[51]和WANG等[52]分别向石灰石/白云石混合物中添加乙酸(AA)和柠檬酸(CA),用以合成MgO负载的CaO基吸附剂。结果发现,AA及CA的存在可以改善吸附剂的多孔结构,减少孔道堵塞和烧结现象的发生,促进了CO2的扩散效率,最终提升钙基吸附剂的CO2吸附性能。
3.3.2 CaO基吸附剂原粉制备工艺及放大制备
在第3.3.1节所述的4种改性方法中,通过使用化学掺杂手段制成的CaO基吸附材料极具实际生产应用的潜力。现阶段,国内外针对掺杂改性的钙基吸附剂的探究基本上都处在实验室小试规模,与实际应用相比还有较大差距。与工业催化剂的生产制备过程相似[53-54],要想实现固体吸附材料的商业化应用,首先要实现批量生产。通常来说,小试试验的制备条件往往不能照搬到规模化制备上来。造成这种结果的原因是多方面的,如随着合成容器的增大(从数百毫升到数升/立方米),使得原料液中传热传质距离变长,导致单位吸附剂在搅拌、混合过程中的能量强度变低,这些因素会间接影响吸附剂晶粒的形成与生长;其次,在后处理过程中,如过滤和洗涤等操作需考虑吸附剂粒子的穿漏,并且该类过程中产生的热量不能忽略;干燥、焙烧时,吸附剂料层通常较厚,从而导致其温度梯度大以及热循环时间短,这决定了吸附剂能否焙烧充分。总之,从吸附剂的规模化制备直至中试所涉及的原料投入量、容器大小、实际工况等与小试试验相比存在较大差别,易导致过程放大效应的产生。相比之下,放大制备所得的试验结果更加贴近于实际工业生产得到的测试结果。因此需要在吸附剂放大生产的过程中优化相关工艺参数,使其更加贴近于工业应用。
PATEL等[55]以吸附剂生产成本、CO2吸附容量、选择性、循环稳定性、再生性能和吸附动力学特性等为基准,提出了吸附剂设计的6个基本要素:① 吸附剂的工作容量至少为每克吸附剂2 mmol CO2;② 得到的CO2纯度在99%以上;③ 吸附剂在水、酸性气体存在以及150 ℃工作温度下具备较高稳定性;④ 吸附剂可完成1 000次CO2吸附/再生循环;⑤ 吸附剂生产成本低于10美元/kg;⑥ 每个循环的快速吸附阶段在5 min内完成。不仅是钙基吸附剂,对于各类固体吸附材料来说,欲实现工业捕集CO2,应将以上6要素作为基本参考,从而进行高性能吸附剂的设计与合成。
CaO基吸附剂的合成方法通常包括共沉淀法、湿混合法、模板剂法、沉积-沉淀法、溶胶-凝胶燃烧法、机械球磨法、火焰喷雾热解法等。为进一步将钙基吸附剂应用于商业化生产中,采用简单易行的合成工艺高效制备高吸附活性的吸附剂是降低生产成本的关键。传统的共沉淀法和湿混合法操作简便,在合适的反应温度、时间、物料配比等条件下,原料中所有组分都能充分混合,从而得到具有均匀分散性的惰性掺杂组分,最终制备出具备优良吸附活性的CO2吸附材料。TONG等[43]开发了一种用于CaO基吸附剂小球的半工业化级制备工艺。通过湿法混合以及喷雾干燥技术,在吸附剂制备过程中引入Al物种,得到了吸附性能良好的钙基前驱体粉末,随后采用挤出-滚圆成型工艺,并以尿素(质量分数5%)为造孔剂制得了吸附剂小球颗粒(粒径0.70~1.25 mm),在双固定床反应器中进行25次CO2吸附/脱附循环后仍能保持0.29 g/g的吸附容量(吸附条件:650 ℃、15% CO2/85% N2、30 min;脱附条件:900 ℃、27% O2/73% CO2、10 min),约为石灰石颗粒的10倍,显示出良好的吸附性能与热稳定性。JIANG等[56]使用过饱和共沉淀法制备了一系列Al改性CaO基吸附剂,并在吸附剂原粉的逐级放大制备(理论产量分别为0.4、1.5以及6.0 kg)过程中,研究发现共沉淀时间及温度、Ca的前驱体浓度和放大倍数对样品吸附性能存在不同程度的影响。通过挤出-滚圆法得到的吸附剂小球样品(粒径0.3~0.6 mm)历经30个CO2吸附/脱附流化床循环测试(吸附条件:650 ℃、14.9% CO2/3.6% O2/8.8% H2O/72.7%N2、20 min;脱附条件:900 ℃、100%N2、5 min),吸附剂小球可保持每克吸附剂5.4 mmol CO2的吸附容量;经40 h热态流化磨损后,该吸附材料平均磨损率为0.14%/h,具有良好的工业应用前景。
3.3.3 CaO基吸附剂成型造粒研究
粉末状的钙基吸附剂不宜在工程实际中应用,需在使用前对其进行成型造粒。反应过程中CaO基吸附剂的磨损破裂会导致其反应活性下降[57],磨损通常由吸附剂颗粒与反应器、吸附剂颗粒之间的碰撞摩擦引起。随着磨损情况的不断发生,可用于CO2碳酸化/煅烧循环过程的吸附剂数量大大降低,因此需要不断向反应器中补充新鲜吸附剂,但会导致生产成本上升。以往研究表明,吸附剂颗粒尺寸及试验条件(加热速率、气流速率、床层温度、设备结构和尺寸)对吸附剂成型颗粒的磨损破碎有很大影响。一般情况下存在3类磨损破碎机制:一次破碎、二次破碎和磨损破碎。其中,一次破碎是由固体颗粒快速加热导致的热应力引起,另外一个因素是在吸附剂颗粒的煅烧过程中,由CO2脱附造成的内部超压引发。二次破碎则是由机械应力导致,通常是颗粒之间与反应器壁碰撞磨损产生的结果。成型颗粒的磨损率往往在第1个反应循环过程时较高,之后每个循环的磨损率通常会逐渐降低,这是由于早期的颗粒破碎以及化学热处理过程能够使得颗粒结构更加牢固。
CaO钙基吸附剂的成型技术通常包括喷雾干燥成型、转动成型、挤压成型、挤出-滚圆成型等多种方法,一些典型的造粒方法[58-60]见表6。
表6 CaO基吸附剂代表性成型造粒方法[60]
Table 6 Summary of the typical granulation of CaO sorbents[60]
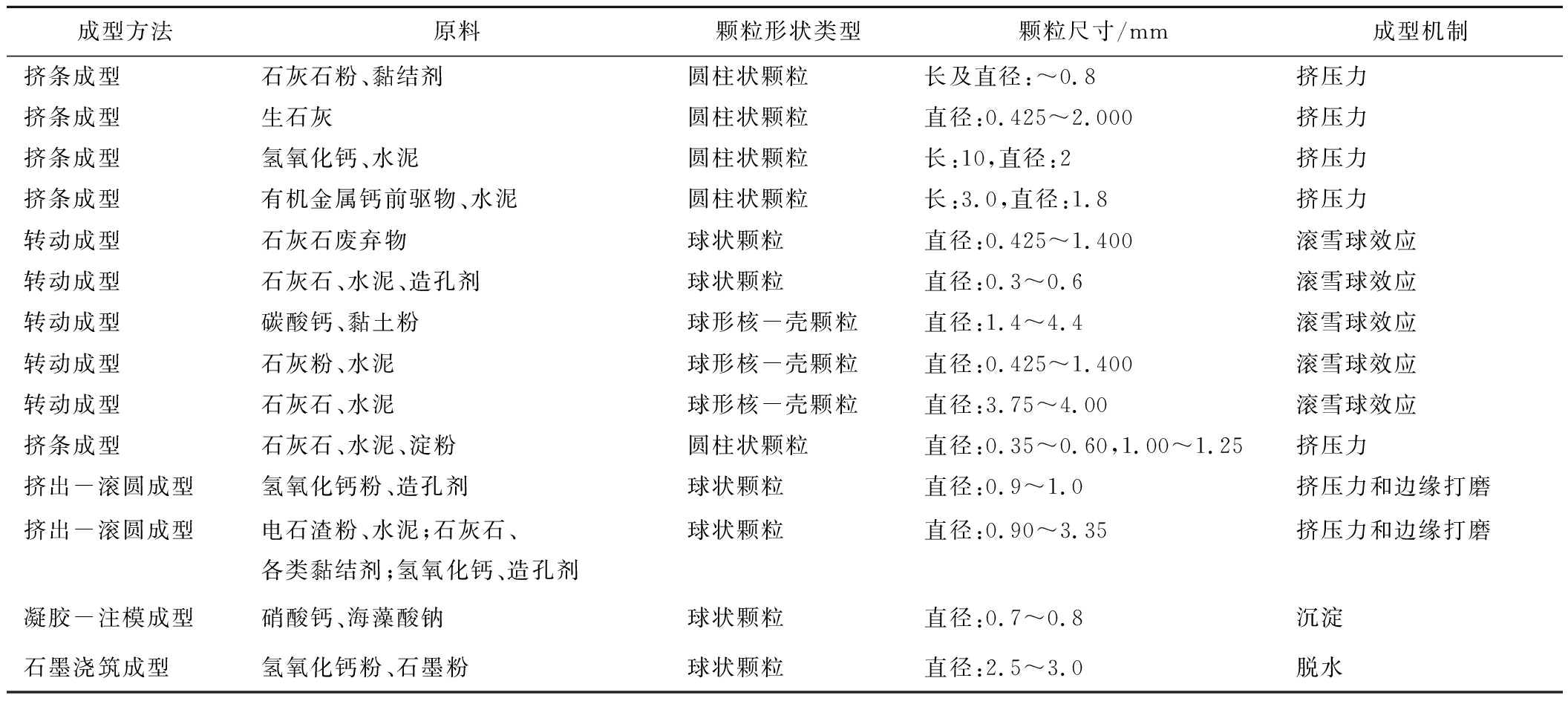
成型方法原料颗粒形状类型颗粒尺寸/mm成型机制挤条成型石灰石粉、黏结剂圆柱状颗粒长及直径:~0.8挤压力挤条成型生石灰圆柱状颗粒直径:0.425~2.000挤压力挤条成型氢氧化钙、水泥圆柱状颗粒长:10,直径:2挤压力挤条成型有机金属钙前驱物、水泥圆柱状颗粒长:3.0,直径:1.8挤压力转动成型石灰石废弃物球状颗粒直径:0.425~1.400滚雪球效应转动成型石灰石、水泥、造孔剂球状颗粒直径:0.3~0.6滚雪球效应转动成型碳酸钙、黏土粉球形核-壳颗粒直径:1.4~4.4滚雪球效应转动成型石灰粉、水泥球形核-壳颗粒直径:0.425~1.400滚雪球效应转动成型石灰石、水泥球形核-壳颗粒直径:3.75~4.00滚雪球效应挤条成型石灰石、水泥、淀粉圆柱状颗粒直径:0.35~0.60,1.00~1.25 挤压力挤出-滚圆成型氢氧化钙粉、造孔剂球状颗粒直径:0.9~1.0挤压力和边缘打磨挤出-滚圆成型电石渣粉、水泥;石灰石、各类黏结剂;氢氧化钙、造孔剂球状颗粒直径:0.90~3.35挤压力和边缘打磨凝胶-注模成型硝酸钙、海藻酸钠球状颗粒直径:0.7~0.8沉淀石墨浇筑成型氢氧化钙粉、石墨粉球状颗粒直径:2.5~3.0脱水
SOLEIMANISALIM等[61]使用压片机将Zr/Al掺杂改性的CaO吸附剂制成直径与长度均为1 mm的圆柱形颗粒,并通过溶胶凝胶法,将正丁氧基锆(锆酸四丁酯)作为锆源,对合成的吸附剂小圆柱进行涂覆,经过750 ℃煅烧后得到分散均匀、高度结晶的ZrO2涂层。与未经涂覆的吸附剂样品相比,介孔ZrO2晶体涂层的存在可以缓解CaO颗粒烧结现象的发生,在热重分析仪测试中CO2初始容量为每千克吸附剂13 mol CO2,经21个碳酸化/煅烧过程后可维持79%的吸附容量(吸附条件:675 ℃、100% CO2,10 min;脱附条件:850 ℃、100% N2、10 min)。LI等[62]通过使用石墨浇铸造粒技术实现了从原料到CaO基吸附剂小球颗粒的一步式造粒,制得的样品显示出均匀的直径以及优良的球形度(粒径为2.5~3.0 mm)。与粉末状吸附剂相比,由于成型过程中存在挤压作用,使得吸附剂小球的比表面积通常会降低、多孔结构易遭到破坏,因此采用了微晶纤维素(MC)作为造孔剂。结果表明加入质量分数30% MC合成的吸附剂小球具备更高的比表面及孔容。在热重分析仪测试中经20个吸附/脱附循环后吸附剂样品的CO2捕集容量为每克吸附剂吸附0.34 g CO2,比未改性的样品高出48%(吸附条件:650 ℃、15%CO2/85% N2,30 min;脱附条件:900 ℃、100%N2、10 min)。挤出-滚圆法是一项较为成熟的成型技术,通过将固体吸附剂粉末制成球形颗粒,最终可提高其抗压特性及耐磨特性。XU等[63]以不同的生物质(纤维素、半纤维素及木质素)为模板剂合成了球形钙基吸附剂,并利用同步热分析仪(STA)依次评价了吸附剂样品的CO2吸附容量和3种生物质组分的热解特性。研究发现用纤维素或半纤维素作模板剂时,制得样品的比表面积明显变大,有利于提高吸附剂对CO2的化学吸附效率。此外,上述3种模板剂对吸附剂的黏结作用顺序依次为:木质素>纤维素>半纤维素。
3.4 高温固体吸附剂小结
锆酸锂基、硅酸锂基以及CaO基固体吸附材料在高温条件下吸附性能优越,相比于MgO和类水滑石等吸附材料,对CO2的吸附容量明显增大,3种高温吸附剂的优缺点见表7。
表7 高温固体吸附剂之间的优缺点
Table 7 Advantages and disadvantages of high-temperature solid sorbents

吸附剂类型优点缺点锆酸锂基吸附剂碳捕集过程中体积变化小,热稳定性高CO2吸附过程中存在动力学限制硅酸锂基吸附剂具有较高的CO2吸附容量、较低的再生温度(<750 ℃)、优异的循环稳定性CO2吸附过程中存在动力学限制CaO基吸附剂原材料来源广泛、价格低廉、吸附速率快、吸附容量高、环境友好、低毒再生时易烧结失活
钙基吸附剂的原粉规模化制备及成型造粒探究虽然近年来取得了一定进展,但综合生产成本、长周期稳定性及机械强度来看,其商业化应用还有很长一段路要走。今后高温固体吸附剂的研究方向应集中在以下几个方面:① 合理有效利用固体废弃物/矿物生产出具有高吸附容量及稳定性的固体吸附剂,实现绿色可持续发展;② 进一步优化吸附剂再生与CO2脱附分离技术,降低工艺成本;③ 探索新型高温吸附剂用于CO2捕集的直接利用与转化技术。
4 结 语
为实现2030年“碳达峰”、2060年“碳中和”的目标,减少碳排放并设法降低大气中CO2浓度已成为亟待解决的问题。碱性液体吸收法是工业中现有的大规模使用且相对成熟的CO2捕集技术,同时科研工作人员仍在积极开展相关工作,研发新型的碳捕集工艺。使用固体吸附剂捕集CO2具有操作方便、无二次污染、脱除率较高、对设备腐蚀性较低等优点,因此吸附法捕集CO2成为最有前景的方法之一。根据工作温度的不同,吸附剂分别为低温、中温和高温吸附剂。低温吸附剂的应用领域最为广泛,但需加大研发力度以进一步提高其吸附容量、选择性及循环稳定性。中温吸附剂可用于CO2的直接捕集与转化,但现阶段吸附容量低及高温下较热稳定性较差阻碍了其工业应用。高温吸附剂中钙基材料由于来源广泛、价格低廉、CO2捕集容量高、吸附速率快,可有效用于工业烟气中CO2的分离脱除。然而CaO基吸附剂在碳酸化/煅烧过程中因烧结而失活以及流化过程中磨损破碎等问题是制约该技术发展的瓶颈,未来研发具有高吸附容量、热稳定性、杂质耐受性、快速CO2吸附/脱附动力学、高抗磨损性能等特性的吸附材料是当前的发展趋势。
[1] SONG C. Global challenges and strategies for control, conversion and utilization of CO2 for sustainable development involving energy, catalysis, adsorption and chemical processing[J]. Catalysis Today, 2006, 115(1/4):2-32.
[2] 张艺峰, 王茹洁, 邱明英, 等. CO2捕集技术的研究现状[J]. 应用化工, 2021, 50(4):1082-1086.
ZHANG Yifeng, WANG Rujie, QIU Mingying, et al. CO2 capture technology research status[J]. Applied Chemical Industry, 2021, 50(4):1082-1086.
[3] GAO W, LIANG S, WANG R, et al. Industrial carbon dioxide capture and utilization: State of the art and future challenges[J]. Chemical Society Reviews, 2020, 49(23):8584-8686.
[4] 袁浩翔. 燃烧后CO2捕获技术研究进展[J]. 当代化工研究, 2019(1):59-61.
YUAN Haoxiang. Research progress of post-combustion CO2 capt-ure technology[J]. Modern Chemical Research, 2019(1):59-61.
[5] CAI T, JOHNSON J K, WU Y, et al. Toward understanding the kinetics of CO2 capture on sodium carbonate[J]. ACS Applied Materials & Interfaces, 2019, 11(9):9033-9041.
[6] WANG J, HUANG L, YANG R, et al. Recent advances in solid sorbents for CO2 capture and new development trends[J]. Energy & Environmental Science, 2014, 7(11): 3478-3518.
[7] DUTCHER B, FAN M, RUSSELL A G. Amine-based CO2 capture technology development from the beginning of 2013:A review[J]. ACS Applied Materials & Interfaces, 2015, 7(4):2137-2148.
[8] BOS M J, KREUGER T, KERSTEN S R A, et al. Study on transport phenomena and intrinsic kinetics for CO2 adsorption in solid amine sorbent[J]. Chemical Engineering Journal, 2019, 377:120374.
[9] CHOI S, DRESE J H, EISENBERGER P M, et al. Application of amine-tethered solid sorbents for direct CO2 capture from the ambient air[J]. Environmental Science & Technology, 2011, 45(6):2420-2427.
[10] DRIESSEN R T, BOS M J, BRILMAN D W F. A multistage fluidized bed for the deep removal of sour gases: Proof of concept and tray efficiencies[J]. Industrial & Engineering Chemistry Research, 2018, 57(11):3866-3875.
[11] 王秀, 郝健, 郭庆杰. 多孔碳结构调控及其在二氧化碳吸附领域的应用[J]. 洁净煤技术, 2021, 27(1):135-143.
WANG Xiu, HAO Jian, GUO Qingjie. Porous carbon structure control and its application in the field of carbon dioxide adsorption[J]. Clean Coal Technology, 2021, 27(1):135-143.
[12] 赵亮, 周宏方, 尹艳山, 等. 活性炭吸附CO2的研究进展[J]. 炭素技术, 2019, 38(5):17-22.
ZHAO Liang, ZHOU Hongfang, YIN Yanshan, et al. Research progress on activated carbon adsorption for carbon dioxide[J]. Carbon Techniques, 2019, 38(5):17-22.
[13] RAGANATI F, CHIRONE R, AMMENDOLA P. CO2 capture by temperature swing adsorption: Working capacity as affected by temperature and CO2 partial pressure[J]. Industrial & Engineering Chemistry Research, 2020, 59(8):3593-3605.
[14] YUE L, XIA Q, WANG L, et al. CO2 adsorption at nitrogen-doped carbons prepared by K2CO3 activation of urea-modified coconut shell[J]. Journal of Colloid and Interface Science, 2018, 511:259-267.
[15] BAE T H, HUDSON M R, MASON J A, et al. Evaluation of cation-exchanged zeolite adsorbents for post-combustion carbon dioxide capture[J]. Energy & Environmental Science, 2013, 6(1):128-138.
[16] 孙锋, 王晨阳, 罗聪, 等. 合成NaY型沸石的CO2吸附特性[J]. 洁净煤技术, 2021, 27(3):225-231.
SUN Feng, WANG Chenyang, LUO Cong, et al. CO2 adsorption characteristics of synthesized NaY zeolite[J]. Clean Coal Technology, 2021, 27(3):225-231.
[17] AKHTAR F, ANDERSSON L, OGUNWUMI S, et al. Structuring adsorbents and catalysts by processing of porous powders[J]. Journal of the European Ceramic Society, 2014, 34(7):1643-1666.
[18] BORUBAN C, NALBANT Esenturk E. Synthesis of CuO nanostructures on zeolite-Y and investigation of their CO2 adsorption properties[J]. Journal of Materials Research, 2017, 32(19):3669-3678.
[19] MURGE P, DINDA S, ROY S. Zeolite-based sorbent for CO2 capture: Preparation and performance evaluation[J]. Langmuir, 2019, 35(46):14751-14760.
[20] WANG Y, HU Z, KUNDU T, et al. Metal-organic frameworks with reduced hydrophilicity for postcombustion CO2 capture from wet flue gas[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(9):11904-11912.
[21] LI P, SHEN Y, WANG D, et al. Selective adsorption-based separation of flue gas and natural gas in zirconium metal-organic frameworks nanocrystals[J]. Molecules, 2019, 24(9):1822.
[22] HU Y, VERDEGAAL W M, YU S H, et al. Alkylamine-tethered stable metal-organic framework for CO2 capture from flue gas[J]. ChemSusChem, 2014, 7(3):734-737.
[23] 张杰, 郭伟, 张博, 等. 空气中直接捕集CO2技术研究进展[J]. 洁净煤技术, 2021, 27(2):57-68.
ZHANG Jie, GUO Wei, ZHANG Bo, et al. Research progress on direct capture of CO2 from air[J]. Clean Coal Technology, 2021, 27(2):57-68.
[24] LU W, SCULLEY J P, YUAN D, et al. Carbon dioxide capture from air using amine-grafted porous polymer networks[J]. The Journal of Physical Chemistry C, 2013, 117(8):4057-4061.
[25] WANG Q, LIU Y, CHEN J, et al. Control of uniform and interconnected macroporous structure in poly HIPE for enhanced CO2 adsorption/desorption kinetics[J]. Environmental Science & Technology, 2016, 50(14):7879-7888.
[26] ARMSTRONG M, SHI X, SHAN B, et al. Rapid CO2 capture from ambient air by sorbent-containing porous electrospun fibers made with the solvothermal polymer additive removal technique[J]. AlChE Journal, 2019, 65(1):214-220.
[27] ZHU H, LIN W, LI Q, et al. Bipyridinium-based ionic covalent triazine frameworks for CO2, SO2, and NO capture[J]. ACS Applied Materials & Interfaces, 2020, 12(7):8614-8621.
[28] WANG J, HUANG L, YANG R, et al. Recent advances in solid sorbents for CO2 capture and new development trends[J]. Energy & Environmental Science, 2014, 7(11):3478-3518.
[29] 赵培玉, 张国杰, 徐英, 等. 硅基多孔材料改性固体吸附剂吸附CO2研究进展[J]. 天然气化工(C1化学与化工), 2017, 42(4):96-103.
ZHAO Peiyu, ZHANG Guojie, XU Ying, et al. Research progress in CO2 adsorption on modified silica-based porous materials[J]. Natural Gas Chemical Industry, 2017, 42(4):96-103.
[30] 郭伟, 石涵, 袁标. 无机固体吸附剂在CO2捕集应用中的研究进展 [J]. 无机盐工业, 2021, 53(12):29-34,42.
GUO Wei, SHI Han, YUAN Biao. Research progress of inorganic solid adsorbents in carbon dioxide capture[J]. Inorganic Chemicals Industry, 2021, 53(12):29-34,42.
[31] 王守桂, 朱庆书, 陈玲, 等. 负载型二氧化碳吸附剂的研究进展[J]. 化工设计通讯, 2019, 45(11):144,82.
WANG Shougui, ZHU Qingshu, CHEN Ling, et al. Advance in study on supported carbon dioxide adsorbents[J]. Chemical Engineering Design Communications, 2019, 45(11):144,82.
[32] YANG Z Z, WEI J J, ZENG G M, et al. A review on strategies to LDH-based materials to improve adsorption capacity and photoreduction efficiency for CO2[J]. Coordination Chemistry Reviews, 2019, 386:154-182.
[33] KOU X, GUO H, AYELE E G, et al. Adsorption of CO2 on Mg-Al-CO3LDHs-derived sorbents with 3D nanoflower-like structure[J]. Energy & Fuels, 2018, 32(4):5313-5320.
[34] ZHU X, CHEN C, SHI Y, et al. Aqueous miscible organic-layered double hydroxides with improved CO2 adsorption capacity[J]. Adsorption, 2020, 49, 8498-8503.
[35] 徐运飞, 李英杰, 王涛, 等. MgO吸附剂捕集CO2的研究进展[J]. 洁净煤技术, 2021, 27(1):125-134.
XU Yunfei, LI Yingjie, WANG Tao, et al. Research progress on MgO sorbents for CO2 capture[J]. Clean Coal Technology, 2021, 27(1):125-134.
[36] GUO Y, TAN C, SUN J, et al. Biomass ash stabilized MgO adsorbents for CO2 capture application[J]. Fuel, 2020, 259:116298.
[37] JEON H, ![]() M L T, HWANG S, et al. Unveiling the carbonation mechanism in molten salt-promoted MgO-Al2O3 sorbents[J]. Journal of CO2 Utilization, 2020, 39:101153.
M L T, HWANG S, et al. Unveiling the carbonation mechanism in molten salt-promoted MgO-Al2O3 sorbents[J]. Journal of CO2 Utilization, 2020, 39:101153.
[38] YAUMI A L, BAKAR M Z A, HAMEED B H. Recent advances in functionalized composite solid materials for carbon dioxide capture[J]. Energy, 2017, 124:461-480.
[39] SALAUDEEN S A, ACHARYA B, DUTTA A. CaO-based CO2 sorbents: A review on screening, enhancement, cyclic stability, regeneration and kinetics modelling[J]. Journal of CO2 Utilization, 2018, 23:179-199.
[40] HU Y, LIU W, YANG Y, et al. CO2 capture by Li4SiO4 sorbents and their applications: Current developments and new trends[J]. Chemical Engineering Journal, 2019, 359:604-625.
[41] BUELENS L C, POELMAN H, DETAVERNIER C, et al. CO2 sorption properties of Li4SiO4 with a Li2ZrO3 coating[J]. Journal of CO2 Utilization, 2019, 34:688-699.
[42] STEFANELLI E, PUCCINI M, VITOLO S, et al. CO2 sorption kinetic study and modeling on doped-Li4SiO4 under different temperatures and CO2 partial pressures[J]. Chemical Engineering Journal, 2020, 379:122307.
[43] TONG X, LIU W, YANG Y, et al. A semi-industrial preparation procedure of CaO-based pellets with high CO2 uptake performance[J]. Fuel Processing Technology, 2019, 193:149-158.
[44] 耿一琪, 郭彦霞, 樊飙, 等. CaO基吸附剂捕集CO2及其抗烧结改性研究进展[J]. 燃料化学学报, 2021, 49(7):998-1013.
GENG Yiqi, GUO Yanxia, FAN Biao, et al. Research progress of calcium-based adsorbents for CO2 capture and anti-sintering modification[J]. Journal of Fuel Chemistry and Technology, 2021, 49(7):998-1013.
[45] SUN J, LIU W, LI M, et al. Mechanical modification of naturally occurring limestone for high-temperature CO2 capture[J]. Energy & Fuels, 2016, 30(8):6597-6605.
[46] VALVERDE J M, BAREA-L PEZ M, PEREJ
PEZ M, PEREJ N A, et al. Effect of thermal pretreatment and nanosilica addition on limestone performance at calcium-looping conditions for thermochemical energy storage of concentrated solar power[J]. Energy & Fuels, 2017, 31(4):4226-4236.
N A, et al. Effect of thermal pretreatment and nanosilica addition on limestone performance at calcium-looping conditions for thermochemical energy storage of concentrated solar power[J]. Energy & Fuels, 2017, 31(4):4226-4236.
[47] ZHANG L, ZHANG B, YANG Z, et al. The role of water on the performance of calcium oxide-based sorbents for carbon dioxide capture: A review[J]. Energy Technology, 2015, 3(1):10-19.
[48] HU Y, LIU W, CHEN H, et al. Screening of inert solid supports for CaO-based sorbents for high temperature CO2 capture[J]. Fuel, 2016, 181:199-206.
[49] AL-JEBOORI M J, NGUYEN M, DEAN C, et al. Improvement of limestone-based CO2 Sorbents for Ca looping by HBr and other mineral acids[J]. Industrial & Engineering Chemistry Research, 2013, 52(4):1426-1433.
[50] NAWAR A, ALI M, KHOJA A H, et al. Enhanced CO2 capture using organic acid structure modified waste eggshell derived CaO sorbent[J]. Journal of Environmental Chemical Engineering, 2021, 9(1):104871.
[51] S NCHEZ Jiménez P E, PEREJ
NCHEZ Jiménez P E, PEREJ N A, BEN
N A, BEN TEZ Guerrero M, et al. High-performance and low-cost macroporous calcium oxide based materials for thermochemical energy storage in concentrated solar power plants[J]. Applied Energy, 2019, 235:543-552.
TEZ Guerrero M, et al. High-performance and low-cost macroporous calcium oxide based materials for thermochemical energy storage in concentrated solar power plants[J]. Applied Energy, 2019, 235:543-552.
[52] WANG K, GU F, CLOUGH P T, et al. Porous MgO-stabilized CaO-based powders/pellets via a citric acid-based carbon template for thermochemical energy storage in concentrated solar power plants[J]. Chemical Engineering Journal, 2020, 390:124163.
[53] HILZ J, HELBIG M, HAAF M, et al. Long-term pilot testing of the carbonate looping process in 1 MWth scale[J]. Fuel, 2017, 210:892-899.
[54] DIEGO M E, ARIAS B, ABANADES J C. Evolution of the CO2 carrying capacity of CaO particles in a large calcium looping pilot plant[J]. International Journal of Greenhouse Gas Control, 2017, 62:69-75.
[55] PATEL H A, BYUN J, YAVUZ C T. Carbon dioxide capture adsorbents: Chemistry and methods[J]. ChemSusChem, 2017, 10(7):1303-1317.
[56] JIANG T, ZHANG H, ZHAO Y, et al. Kilogram-scale production and pelletization of Al-promoted CaO-based sorbent for CO2 capture[J]. Fuel, 2021,301:121049.
[57] CHEN H, ZHAO C, YANG Y. Enhancement of attrition resistance and cyclic CO2 capture of calcium-based sorbent pellets[J]. Fuel Process Technology, 2013, 116:116-122.
[58] BRODA M, MANOVIC V, ANTHONY E J, et al. Effect of pelletization and addition of steam on the cyclic performance of carbon-templated, CaO-based CO2 sorbents[J]. Environmental Science & Technology, 2014, 48(9):5322-5328.
[59] TONG X, LIU W, YANG Y, et al. A semi-industrial preparation procedure of CaO-based pellets with high CO2 uptake performance[J]. Fuel Process Technology, 2019, 193:149-158.
[60] HU Y, LU H, LI H. Single step fabrication of spherical CaO pellets via novel agar-assisted moulding technique for high-temperature CO2 capture[J]. Chemical Engineering Journal, 2021, 404:127137.
[61] SOLEIMANISALIM A H, SEDGHKERDAR M H, KARAMI D, et al. Pelletizing and coating of synthetic zirconia stabilized calcium-based sorbents for application in calcium looping CO2 capture[J]. Industrial & Engineering Chemistry Research, 2017, 56(18):5395-5402.
[62] LI H, QU M, YANG Y, et al. One-step synthesis of spherical CaO pellets via novel graphite-casting method for cyclic CO2 capture[J]. Chemical Engineering Journal, 2019, 374:619-625.
[63] XU Y, DING H, LUO C, et al. Effect of lignin, cellulose and hemicellulose on calcium looping behavior of CaO-based sorbents derived from extrusion-spherization method[J]. Chemical Engineering Journal, 2018, 334:2520-2529.
